(写真:ロイター)
2025年9月に米FDA(食品医薬品局)が承認した主な新薬と適応拡大を、領域別にまとめました。
INDEX
【新薬】ノバルティスの蕁麻疹治療薬「Rhapsido」など
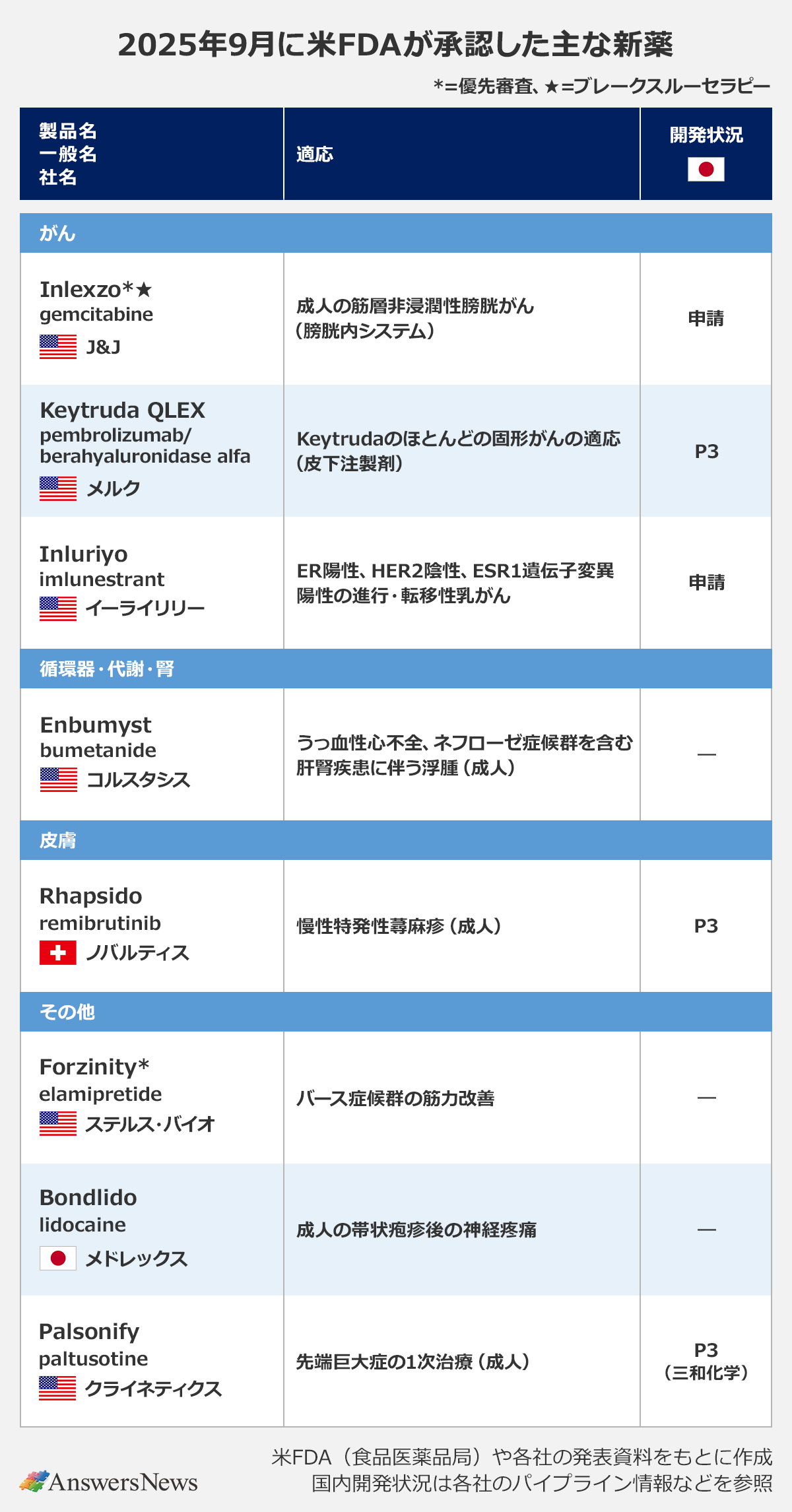
がん
Inlexzo|米ジョンソン・エンド・ジョンソン
「Inlexzo」は、抗がん剤gemcitabine(一般名)を持続的に放出する膀胱内システム。BCG不応性の成人の筋層非浸潤性膀胱がん治療薬として承認されました。外来で膀胱内に挿入することができ、1サイクル3週間、最大14サイクルまで膀胱内に留置されます。国際共同臨床第2b相(P2b)試験の完全奏効率は82.4%で、奏功期間の中央値は25.8カ月。日本でも同試験の結果をもとに今年9月に申請しています。
Keytruda QLEX|米メルク
「Keytruda QLEX」は、抗PD-1抗体「Keytruda」(一般名・pembrolizumab)の皮下注製剤。韓国アルテオジェンが開発したヒトヒアルロニダーゼの変異体berahyaluronidase alfaを配合することで皮下注化を実現しており、Keytrudaが適応を持つほとんどの固形がんの治療に使用できます。非小細胞肺がんを対象とするP3試験で静注製剤との同等性が確認されました。日本ではP3試験の段階にあります。
Inluriyo|米イーライリリー
「Inluriyo」(imlunestrant)は、選択的エストロゲン受容体分解薬(SERD)。「ER陽性、HER2陰性、ESR1遺伝子変異陽性の進行・転移性乳がん」の適応で承認されました。少なくとも1つ以上の内分泌療法を受けたあとに進行した成人患者が対象です。承認の根拠となったP3試験では、内分泌療法に比べて進行または死亡のリスクを38%低下させました。日本でも申請中です。
循環器・代謝・腎
Enbumyst|米コルスタシス
「Enbumyst」は、ループ利尿薬bumetanideの点鼻スプレー。「うっ血性心不全、ネフローゼ症候群を含む肝腎疾患に伴う浮腫」の適応で承認されました。臨床試験では、静注製剤との同等性が確認されました。
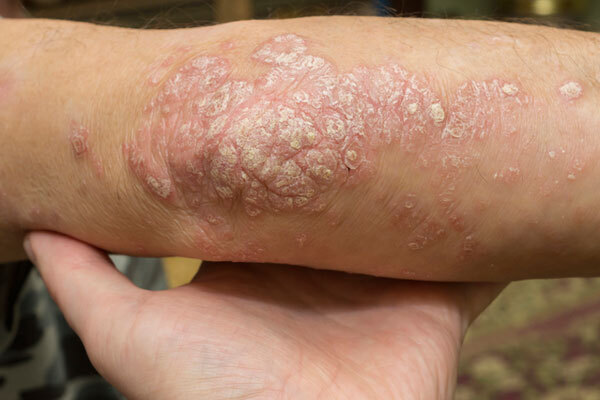
皮膚
Rhapsido|スイス・ノバルティス
BTK阻害薬「Rhapsido」(remibrutinib)は、1日2回投与の慢性特発性蕁麻疹治療薬。ヒスタミンや炎症性メディエーターの放出を抑える作用を持ち、抗ヒスタミン薬を使用しても症状が持続する成人患者に使用されます。日本や欧州、中国で申請中です。
その他
Forzinity|米ステルス・バイオ
「Forzinity」(elamipretide)は、バース症候群に対する初めての治療薬として迅速承認されました。体重30kg以上の小児と成人の筋力改善を適応としています。バース症候群はミトコンドリア機能異常を伴うX連鎖性の遺伝性疾患で、Forzinityはミトコンドリアを標的とするペプチド医薬。承認の根拠となった臨床試験では、膝伸筋群の筋力の改善が確認されました。
Bondlido|メドレックス
「Bondlido」(lidocaine)は、成人の帯状疱疹後の神経疼痛の適応で承認を取得しました。同薬はイオン液体を利用したメドレックス独自の技術を使って開発されたlidocaineテープ剤で、パップ剤より皮膚刺激性が少なく、粘着力に優れると考えられています。メドレックスとデ・ウエスタン・セラピテクス研究所が共同開発しました。
Palsonify|米クライネティクス
「Palsonify」(paltusotine)は、非ペプチドのソマトスタチン受容体2(SST2)作動薬。手術で効果不十分または手術が治療選択肢にない先端巨大症に対する1次治療として承認されました。P3試験では症状の負担軽減と、迅速かつ持続的で一貫した生化学的コントロールを示しました。欧州でも申請中で、日本では導出先の三和化学研究所が先端巨大症と下垂体性巨人症の適応でP3試験を進めています。
【適応拡大】「Opzelura」アトピーの小児適応拡大など
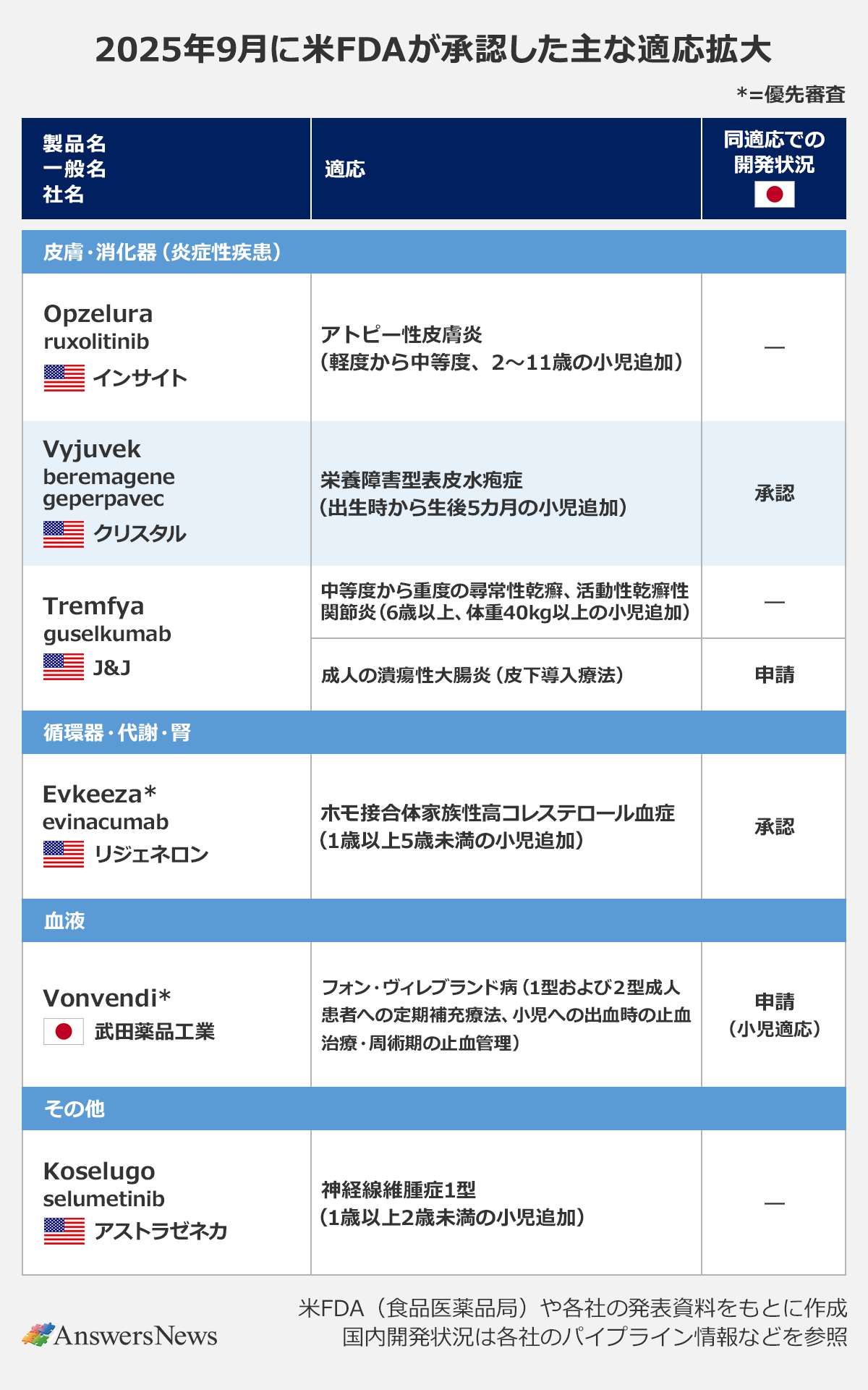
皮膚・消化器(炎症性疾患)
Opzelura|米インサイト
外用JAK阻害薬「Opzelura」(ruxolitinib)は、軽度から中等度のアトピー性皮膚炎の適応で2~11歳の小児を対象に追加しました。同薬は21年に12歳以上のアトピー性皮膚炎を対象に承認を取得。日本ではマルホが22年にライセンスを獲得しました。
Vyjuvek|米クリスタル・バイオ
栄養障害型表皮水疱症治療薬「Vyjuvek」(beremagene geperpavec)は、出生時から使用できるようになりました。あわせて、患者自身が塗布できるよう添付文書が改訂されました。同薬は、遺伝子治療薬として23年に生後6カ月以降を対象に承認を取得。日本では今年7月に承認され、出生時から使用が認められています。
Tremfya|米ジョンソン・エンド・ジョンソン
抗IL-23p19抗体「Tremfya」(guselkumab)は、全身療法や光線療法が治療候補になる中等度から重度の尋常性乾癬、活動性乾癬性関節炎の適応で6歳以上かつ体重40kg以上の小児を対象に追加しました。成人では尋常性乾癬で17年、活動性乾癬性関節炎で20年に承認されています。成人の潰瘍性大腸炎の適応で皮下導入療法の承認も取得。静脈導入療法と皮下導入療法を選択できるようになりました。日本でも皮下導入療法を申請中です。
循環器・代謝・腎
Evkeeza|米リジェネロン
ホモ接合体家族性高コレステロール血症治療薬の抗ANGPTL3抗体「Evkeeza」(evinacumab)は、1歳以上5歳未満の小児を対象に追加しました。食事療法や運動療法、そのほか脂質低下療法の補助として使用されます。日本では24年5月に5歳未満または体重15kg未満の小児への使用が承認されています。
血液
Vonvendi|武田薬品工業
非血漿由来遺伝子組換え型のフォン・ヴィレブランド病(VWD)治療薬「Vonvendi」は、1型および2型の成人患者に対する定期補充療法と、小児患者に対する出血時の止血治療・周術期の止血管理で使用できるようになりました。従来は、成人患者の出血時の止血治療・周術期の止血管理、重度3型VWDの成人に対する定期補充療法が対象でした。日本では今年6月、小児への用法・用量追加を申請しました。
その他
Koselugo|英アストラゼネカ
MEK阻害薬「Koselugo」(selumetinib)は、神経線維腫症1型の適応で1歳以上2歳未満の小児を対象に追加するとともに、1歳以上に使用できる経口顆粒剤が承認されました。同薬は20年に2歳以上の小児を対象に承認。日本では3歳以上への使用が認められています。
【バイオシミラー】バイオコン、ヒクマがそれぞれdenosumab承認

Bosaya/Aukelso|インド・バイオコン
「Bosaya」と「Aukelso」は抗RANKL抗体denosumabのバイオシミラー。Bosayaは骨粗鬆症治療薬「Prolia」、Aukelsoは骨巨細胞腫などの治療薬「Xgeva」に対応しています。
Enoby/Xtrenbo|英ヒクマ
「Enoby」と「Xtrenbo」は、米国で7番目となるdenosumabのバイオシミラー。EnobyがProlia、XtrenboがXgevaに対応します。いずれもハンガリーのゲデオン・リヒターが開発したもので、ヒクマは米国での申請・商業化を担います。