国内製薬各社の2026年3月第3四半期、25年12月期第4四半期の決算発表から、主な新薬開発パイプラインの動きをピックアップ。随時更新(公開日:1月30日)。
武田薬品工業(26年3月期3Q、1月29日発表)
申請
【中国】TAK-861(一般名・oveporexton)|ナルコレプシータイプ1
次期主力製品として大型化を期待する自社創製のオレキシン受容体作動薬。1月に中国で申請。米国でも申請済みだがまだ受理はされていない。日本でも段階的申請を開始した。
P3開始
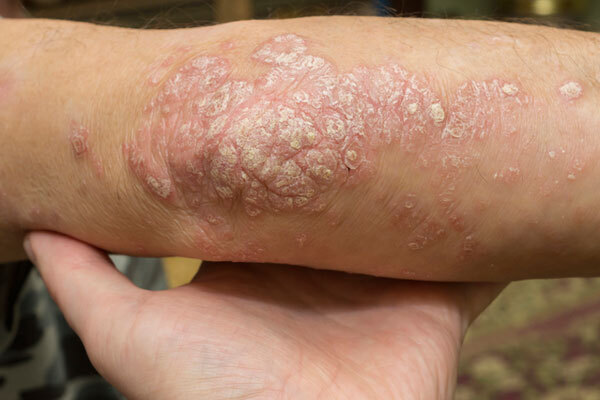
【グローバル】TAK-279(zasocitinib)|乾癬(小児)
米ニンバス・セラピューティクスから買収したTYK2阻害薬。乾癬を対象に、成人に続いて小児のP3試験を開始。
P1開始
TAK-188|固形がん
CCR8を標的とする抗体薬物複合体(ADC)。
TAK-781|原発性硬化性胆管炎
CYP7A1を標的とするGalNAc siRNA製剤。
パイプライン追加
TAK-921/IBI343|胃がん・固形がん
中国のイノベント・バイオロジクスから導入した抗Claudin18.2ADC。胃がん3次治療を対象に日本と中国でP3試験が行われているほか、固形がんを対象としたP1試験を実施中。武田薬品は中国・香港・マカオ・台湾以外での独占的権利を持つ。
TAK-928/IBI363|扁平上皮非小細胞肺がん・固形がん
中国のイノベント・バイオロジクスから導入したα-biased IL-2/PD-1二重特異性抗体融合タンパク質。グローバルで扁平上皮非小細胞肺がんの2次治療を対象としたP3試験が行われており、固形がんでもP1試験を行っている。武田薬品はグローバルでの共同開発と米国での共同商業化を主導し、米国と中国・香港・マカオ・台湾以外での独占的商業権を持つ。
中外製薬(25年12月期4Q、1月29日発表)
承認
【日本】テセントリク(一般名・アテゾリズマブ)|胸腺がん(適応拡大)
抗PD-L1抗体。25年12月に切除不能な胸腺がんへの適応拡大が承認。
申請
【日本】テセントリク|膀胱がん術後補助療法(適応拡大)
MRD陽性の膀胱がんにおける術後補助療法への適応拡大を1月に申請。
P3開始
【日本】RG6330|非小細胞肺がん
ロシュから導入したKRAS G12C阻害薬。非小細胞肺がんの1次治療を対象としたP3試験を1月に開始。
【日本】RG6102|アルツハイマー病
抗アミロイドベータ/TfR1融合タンパク。2025年11月にP3試験を開始。
【日本】RG6615|高血圧症
米アルナイラムが創製し、スイス・ロシュと共同開発しているRNAi治療薬。25年11月に日本でもP3試験がスタート。
パイプライン追加
【日本】スパルセンタン|IgA腎症
エンドセリン/アンジオテンシンII受容体二重拮抗薬。レナリスファーマ買収に伴いパイプラインに追加。P3試験で良好な結果を得ており、26年の申請を予定。
開発中止
【日本】テセントリク|非小細胞肺がん(P3)
非小細胞肺がんの周術期を対象にP3試験を行っていたが、開発を中止。
【グローバル】BRY10|慢性疾患(P1)
自社創製の抗体医薬。慢性疾患を対象に行っていた開発を中止。