2026年は製薬業界にとってどんな年になるでしょうか。今年の業界のトピックスをピックアップし、新年を展望します。
AG戦略再考必至、MFNの影響注視
4月の薬価制度改革で注目されるのは、オーソライズド・ジェネリック(AG)の薬価算定見直しの影響です。4月以降、新たに収載されるAG・バイオAGの薬価は先発品・先行品と同額とし、改定時も先発品・先行品と価格帯を集約することになりました。
AG・バイオAGはこれまで市場で圧倒的なシェアを獲得してきましたが、価格のメリットがなくなれば優位性も損なわれます。ビジネスモデルとしては厳しくなり、AGを柱とする後発品メーカーが戦略の再考を迫られるのは必至。先発品メーカーの特許切れ対策にも影響を与えそうです。
昨年、日本維新の会が与党に入ったことで一気に議論が進んだOTC類似薬の保険給付では、患者に薬剤費の一部の追加負担を求める仕組みが新たに創設されます。まずは77成分約1000品目を対象に、薬剤費の4分の1を「特別の料金」として患者に負担してもらう仕組みを27年3月に開始する方針で、今年は具体的な制度設計の議論が行われます。24年10月に始まった長期収載品の選定療養では、患者の自己負担が「後発品との差額の4分の1」から「2分の1」へと引き上げられます。こうした制度変更は、市場の動向や企業の業績、戦略にどのような影響を与えるのでしょうか。

米国の「最恵国待遇(MFN)価格」の影響も引き続き注視する必要があります。トランプ大統領は昨年、欧米の主要製薬企業17社にMFN価格の設定を求める書簡を送り、このうち年末までに14社と合意。米側は国内価格の引き下げとともに他国での価格引き上げを求めています。MFNを導入すると米国の価格は他の先進国の最低価格と同水準になるため、製薬企業が価格の低い国で新薬の発売を控える可能性も指摘されています。
中央社会保険医療協議会(中医協)が昨年末にまとめた26年度薬価制度改革の骨子では、MFNについて「機動的な対応ができるよう、革新的新薬の薬価のあり方について引き続き検討する」とされました。27年度の中間年改定については「着実に実施する」とされており、対象品目の範囲や適用する改定ルールなどがまた議論になります。
武田薬品でトップ交代、アステラスと第一三共は新中計
企業の動きに目を向けると、武田薬品工業では6月、クリストフ・ウェバー社長CEOが退任し、後任に米国事業トップを務めるジュリー・キム氏が就任します。同社のCEO交代は11年ぶり。自社創製のナルコレプシー治療薬など大型品候補の申請が近づく中、業績拡大へ手腕が試されます。
アステラス製薬と第一三共は、現在の中期経営計画が3月で終了。26年度からスタートする新たな中計で、どのような成長戦略を描くのか注目です。27年度に主力の前立腺がん治療薬「イクスタンジ」の特許切れを控えるアステラスは、重点戦略製品をいかに最大化して特許切れを乗り切るかが焦点。第一三共は、豊富なパイプラインに投資しながら外部資源の取り込みを進め、がん領域を引き続き強化していくことになりそうです。
後発品メーカーでは昨年、製造所の集約や品目統合に向けた企業間連携の動きが顕在化しました。MeijiSeikaファルマとダイトが打ち出したコンソーシアム構想には複数の企業が参画し、沢井製薬と日医工など個別の協業も見られました。
約190社に上る後発品メーカーのうち、7割以上は取り扱い製品が50品目に満たない小規模なメーカーです。現時点で明らかになっている集約・統合の動きは一定以上の規模の企業が中心で、こうした流れが小規模メーカーに波及していくのか注目されます。
サンバイオとオンコリス、初の製品発売へ
国内では今年も注目の新薬が登場します。
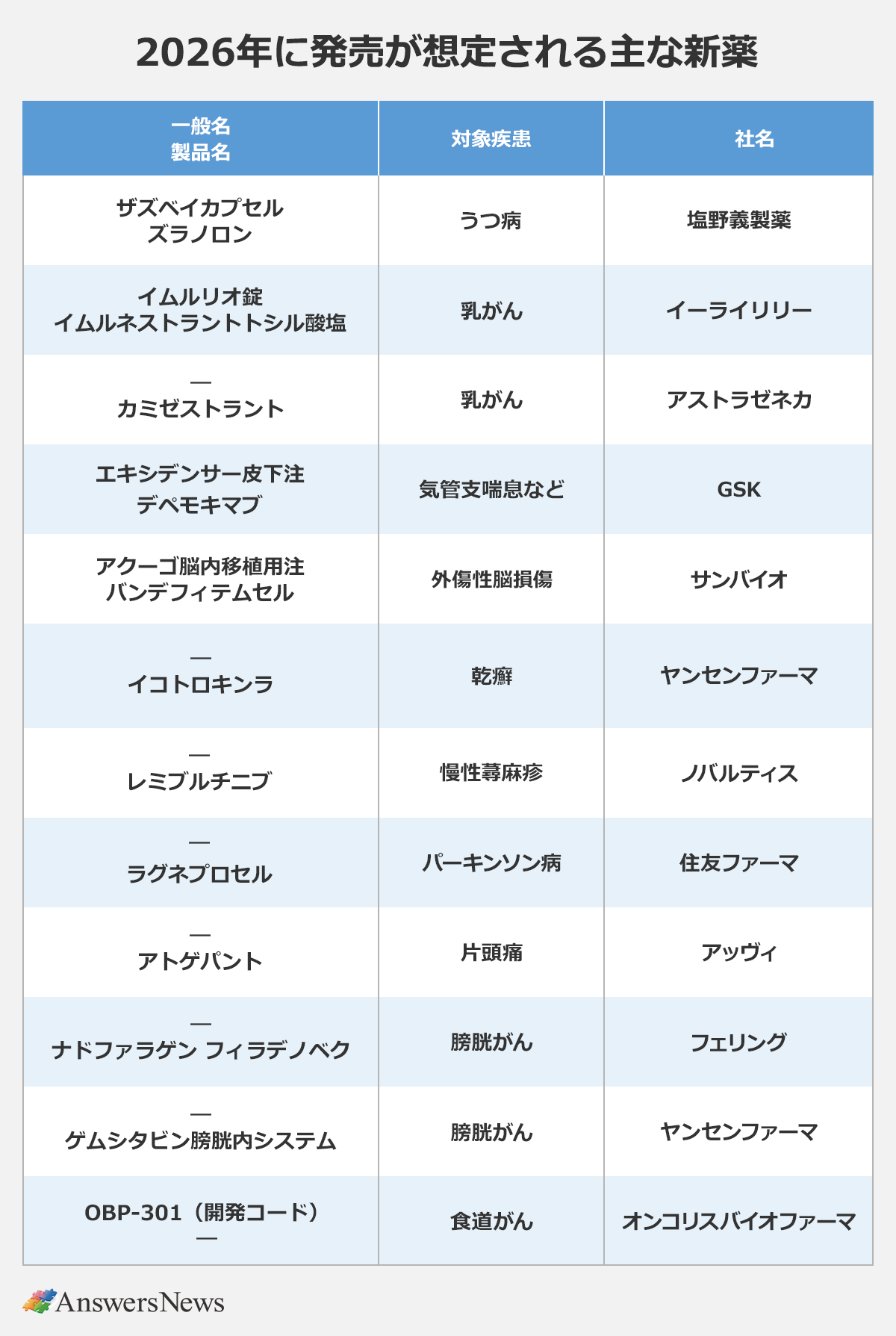
フェリング・ファーマは、筋層非浸潤性膀胱がん向けの遺伝子治療薬ナドファラゲン フィラデノベク(一般名)が承認の見通し。同じ疾患には、ヤンセンファーマがゲムシタビンを局所送達する膀胱内システム「TAR-200」を申請中で、こちらも年内の承認が見込まれます。同社は、IL-23受容体を阻害する初の標的経口ペプチドとなるイコトロキンラも申請中です。
住友ファーマは昨年8月、iPS細胞由来のドパミン神経前駆細胞をパーキンソン病治療薬として申請。先駆け審査指定制度の対象に指定されており、順調にいけば2月ごろの承認が想定されます。iPS細胞を使った再生医療等製品では、クオリプスが重症心不全の治療に使う心筋シートを申請中で、これも年内承認の可能性があります。
レッドオーシャンとなった片頭痛治療薬では、昨年発売の「ナルティーク」(ファイザー)に続き、アッヴィの経口CGRP受容体拮抗薬アトゲパントが急性期治療と発症抑制の両適応で申請中。ルンドベック・ジャパンは抗CGRP抗体エプチネズマブを発症抑制を対象に申請中で、承認されれば同社にとって日本で初めて承認を取得する製品となります。
がん領域では、国内初の経口SERD(選択的エストロゲン受容体分解薬)となる「イムルリオ」(日本イーライリリー)が近く薬価収載の見通し。アストラゼネカも経口SERDのカミゼストラントを申請中です。
初の製品上市にこぎつけるベンチャーもあります。2001年創業のサンバイオは24年に条件・期限付き承認を取得した外傷性脳損傷向け再生医療等製品「アクーゴ」について、昨年12月に出荷条件解除に必要な一部変更承認を取得。今年、薬価収載を経て発売する見通しです。
04年創業のオンコリスバイオファーマは、腫瘍溶解ウイルス「OBP-301」を昨年12月に申請。先駆け審査指定制度の対象品目で、今年中ごろの承認が想定されます。同社は薬価収載を経て年内の販売開始を計画しています。