(写真:ロイター)
2025年7月に米FDA(食品医薬品局)が承認した主な新薬と適応拡大を、領域別にまとめました。
【新薬】経口HAE治療薬「Ekterly」など
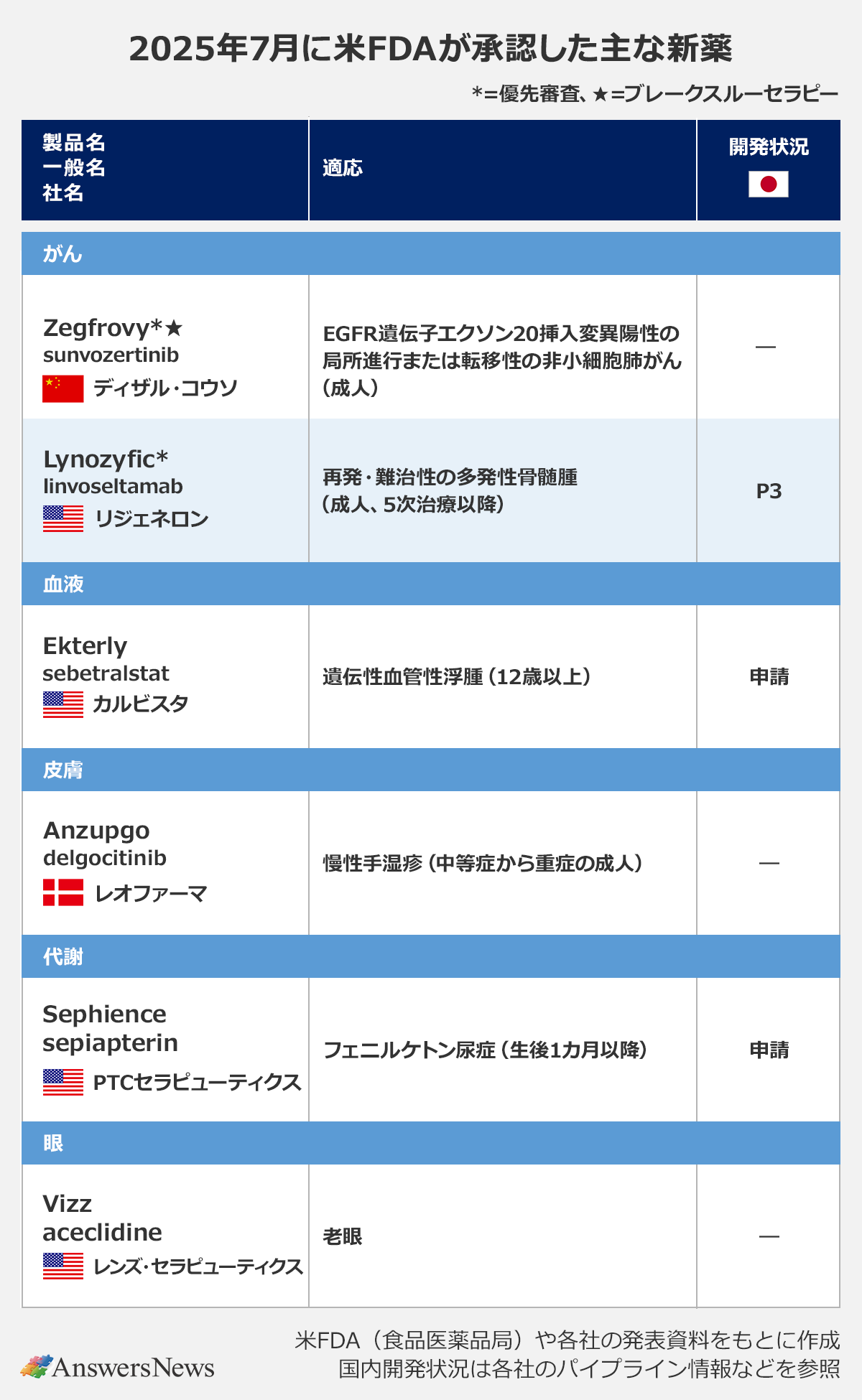
がん
Zegfrovy|中国ディザル・コウソ・ファーマシューティカル
「Zegfrovy」(一般名・sunvozertinib)は、不可逆的EGFR阻害薬。EGFR遺伝子エクソン20挿入変異陽性の局所進行・転移性非小細胞肺がんの治療薬として、臨床第1/2相(P1/2)試験の全奏効率と奏功期間のデータをもとに迅速承認を取得しました。対象は、プラチナベースの化学療法を実施中または実施後に進行した成人患者。中国では2023年に承認されています。
Lynozyfic|米リジェネロン
抗BCMA/CD3二重特異性抗体「Lynozyfic」(linvoseltamab)は、再発・難治性の多発性骨髄腫治療薬。プロテアソーム阻害薬、免疫調節薬、抗CD38抗体を含む4つ以上の前治療を受けた成人患者に使用されます。迅速承認の根拠となったP1/2試験の全奏効率は70%で、完全奏効率は45%。欧州では今年4月に3つ以上の前治療を受けた患者を対象に承認されました。日本ではP3試験の段階にあります。
血液
Ekterly|米カルビスタ・ファーマシューティカルズ
血漿カリクレイン阻害薬「Ekterly」(sebetralstat)は、遺伝性血管性浮腫(HAE)の急性発作治療薬。HAEのオンデマンド療法に使用できる薬は約10年ぶりで、経口薬は初めて。12歳以上の患者を対象とするP3試験の結果に基づいて承認されました。欧州でも近く承認される見通しで、日本では今年1月に申請。さらに、グローバルで2~11歳までの小児を対象とするP3試験が進行中です。
皮膚
Anzupgo|デンマーク・レオファーマ
外用JAK阻害薬「Anzupgo」(delgocitinib)は、中等症から重症の慢性手湿疹治療薬として承認されました。クリーム製剤で、局所コルチコステロイドで効果不十分の患者や局所コルチコステロイドが適さない患者が対象です。欧州でも承認済み。同薬は日本たばこ産業(JT)が創製したもので、日本ではアトピー性皮膚炎治療薬「コレクチム軟膏」として販売されています。
代謝
Sephience|米PTCセラピューティクス
「Sephience」(sepiapterin)は、フェニルケトン尿症(高フェニルアラニン血症)治療薬。承認の根拠となったP3試験では、統計学的に有意で臨床的に意義のある血中フェニルアラニン濃度の低下を示しました。欧州と日本でも同試験の結果をもとに申請中です。
眼
Vizz|米レンズ・セラピューティクス
「Vizz」(aceclidine)は老眼治療薬。毛様体筋への刺激を最小限に抑えつつ、虹彩に作用して瞳孔を選択的に縮小させる作用を持ち、これにより近見視力を改善します。P3試験では最大10時間の近見視力の改善効果が確認されました。
【適応拡大】Kerendiaの慢性心不全など
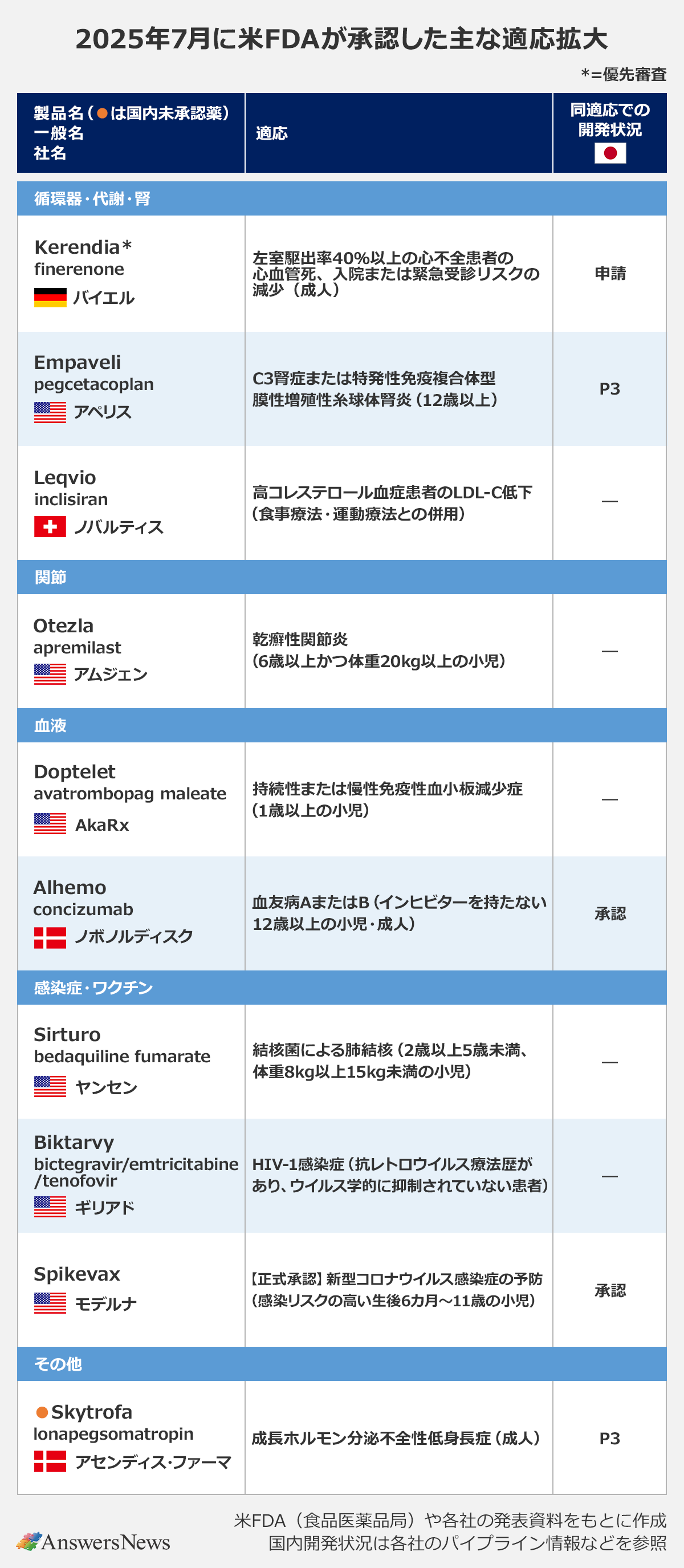
循環器・代謝・腎
Kerendia|独バイエル
非ステロイド型選択的ミネラルコルチコイド受容体拮抗薬「Kerendia」(finerenone)は、新たに左室駆出率40%以上の成人心不全患者に使用できるようになりました。臨床試験では、心血管死、入院または緊急受診のリスクの有意な減少が確認されました。同薬は2型糖尿病に伴う慢性腎臓病の適応で21年に米国、22年に日本と欧州、中国で承認。日本や欧州、中国で慢性心不全への適応拡大を申請中です。
Empaveli|米アペリス
補体(C3)阻害薬「Empaveli」(pegcetacoplan)は、C3腎症または特発性免疫複合体型膜性増殖性糸球体腎炎(IC-MPGN)に適応拡大。P3試験では、タンパク尿の減少、腎機能の安定化、C3沈着物の大幅な消失を示しました。同薬は発作性夜間ヘモグロビン尿症治療薬として各国で承認。欧州ではスウェーデン・SobiがC3腎症とIC-MPGNへの適応拡大を申請中で、日本でも同社が今年後半に適応拡大を申請する見通しです。
Leqvio|スイス・ノバルティス
高コレステロール血症向けsiRNA製剤「Leqvio」(inclisiran)は、単剤療法として食事療法、運動療法との併用が承認されました。従来はスタチン療法と併用する必要がありました。今回の承認により、第1選択薬として使用できるようになります。日本ではスタチンとの併用で承認されています。
血液
Alhemo|デンマーク・ノボノルディスク
抗TFPI抗体「Alhemo」(concizumab)は、血友病AまたはBの適応で、インヒビターを持たない12歳以上の小児・成人に対象を拡大しました。出血発作の予防または頻度の低減を目的に1日1回投与します。欧州でも近く対象の拡大が承認される見通し。日本では世界に先駆け、24年にインヒビター非保有患者への使用が承認されました。
感染症・ワクチン
Biktarvy|米ギリアド
HIV-1感染症治療薬「Biktarvy」(bictegravir/emtricitabine/tenofovir)は、抗レトロウイルス療法(ART)歴があり、ウイルス学的に抑制されていない患者への使用が可能になりました。対象は、インテグラーゼ阻害薬、emtricitabine、tenofovirに対する耐性が知られていないまたは疑われていない患者。従来はART歴がない患者や、ウイルス学的に抑制されている患者の切り替えに使用が限られていました。今回の承認により、治療を中止・中断した後、ウイルス学的に抑制されていない患者への再投与が可能となります。
Spikevax|米モデルナ
新型コロナウイルス感染症向けmRNAワクチン「Spikevax」は、感染リスクの高い生後6カ月~11歳の小児への正式承認を取得。従来は緊急使用許可(EUA)に基づき提供されていました。
その他
Skytrofa|デンマーク・アセンディス ファーマ
週1回投与のヒト成長ホルモン製剤「Skytrofa」(lonapegsomatropin)は、成長ホルモン分泌不全性低身長症(GHD)の成人に対する内因性成長ホルモン補充療法として承認されました。同薬は21年、小児GHD治療薬として承認。プラセボ対照のP3試験の結果をもとに適応拡大しました。日本では小児および成人対象のP3試験がそれぞれ進行中です。
【バイオシミラー】バイオコンのinsulin aspart

Kirsty|インド・バイオコン
「Kirsty」は、米国で2剤目となる超速効型インスリンアナログ製剤「NovoLog」(insulin aspart)のバイオシミラー。欧州とカナダでも承認済みです。