
(写真:ロイター)
2025年10月に米FDA(食品医薬品局)が承認した主な新薬と適応拡大を、領域別にまとめました。
【新薬】バイエルのホットフラッシュ治療薬「Lynkuet」など
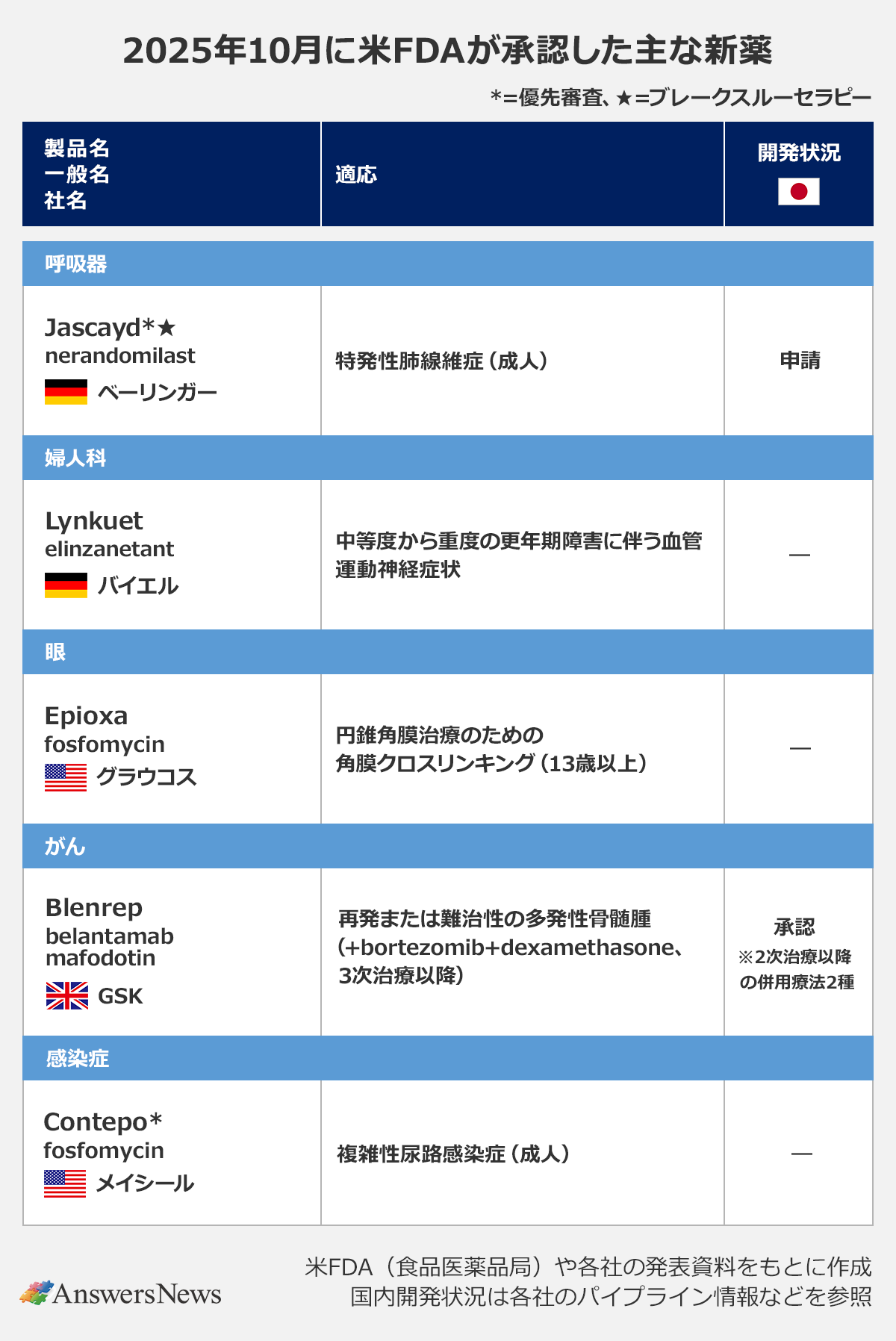
呼吸器
Jascayd|独ベーリンガーインゲルハイム
PDE4B阻害薬「Jascayd」(一般名・nerandomilast)は、米国で10年以上ぶりとなる特発性肺線維症治療薬。肺の炎症と線維化を抑制する作用を持ち、承認の根拠となった2つの臨床試験では、努力肺活量のベースラインからの絶対変化量をプラセボに比べて有意に改善しました。日本や欧州、中国でも申請中です。
婦人科
Lynkuet|独バイエル
NK1/NK3受容体拮抗薬「Lynkuet」(elinzanetant)は、中等度から重度の更年期障害に伴う血管運動神経症状(VMS、ホットフラッシュ)の治療薬として承認を取得。キスペプチン/ニューロキニンB/ダイノルフィン(KNDy)ニューロン上のNK1およびNK3受容体シグナル伝達を阻害し、ほてりに関連する体温調節に関する神経活動を調節します。英国やカナダで承認済みで、欧州では申請中。アステラス製薬の「VEOZAH」(fezolinetant)の競合品となります。
眼
Epioxa|米グラウコス・コーポレーション
「Epioxa」(riboflavin 5’-phosphate)は、13歳以上の円錐角膜患者の角膜クロスリンキングで使用される点眼液。Epioxaを使うことで、角膜上皮の除去が不要になると期待されています。400人以上を対象とする臨床第3相(P3)試験の結果をもとに承認されました。
がん
Blenrep|英グラクソ・スミスクライン
抗BCMA抗体薬物複合体(ADC)「Blenrep」(belantamab mafodotin)は、少なくとも2つ以上の治療を受けた再発または難治性の多発性骨髄腫患者に対するbortezomib、dexamethasoneとの併用療法で承認されました。同薬は20年に5次治療以降で迅速承認を取得したものの、検証的試験の結果を受け23年に承認を取り下げていましたが、今回、新たに2次治療以降の患者を対象に行ったP3試験をもとに承認を取得。同試験では、daratumumabベースの3剤併用療法と比べて3次治療以降の患者の死亡のリスクを51%低減させました。日本や欧州、英国などでは2次治療以降に対する併用療法として承認されています。
感染症
Contepo|米メイシール・ファーマシューティカルズ
「Contepo」は、抗生物質fosfomycinの注射剤で、成人の複雑性尿路感染症治療薬として承認されました。β-ラクタム系抗生物質より早い段階で細菌の細胞壁を標的とし、細胞壁合成の最初のステップを阻害する作用を持ちます。
【適応拡大】RevuforjのNPM1遺伝子変異AMLなど
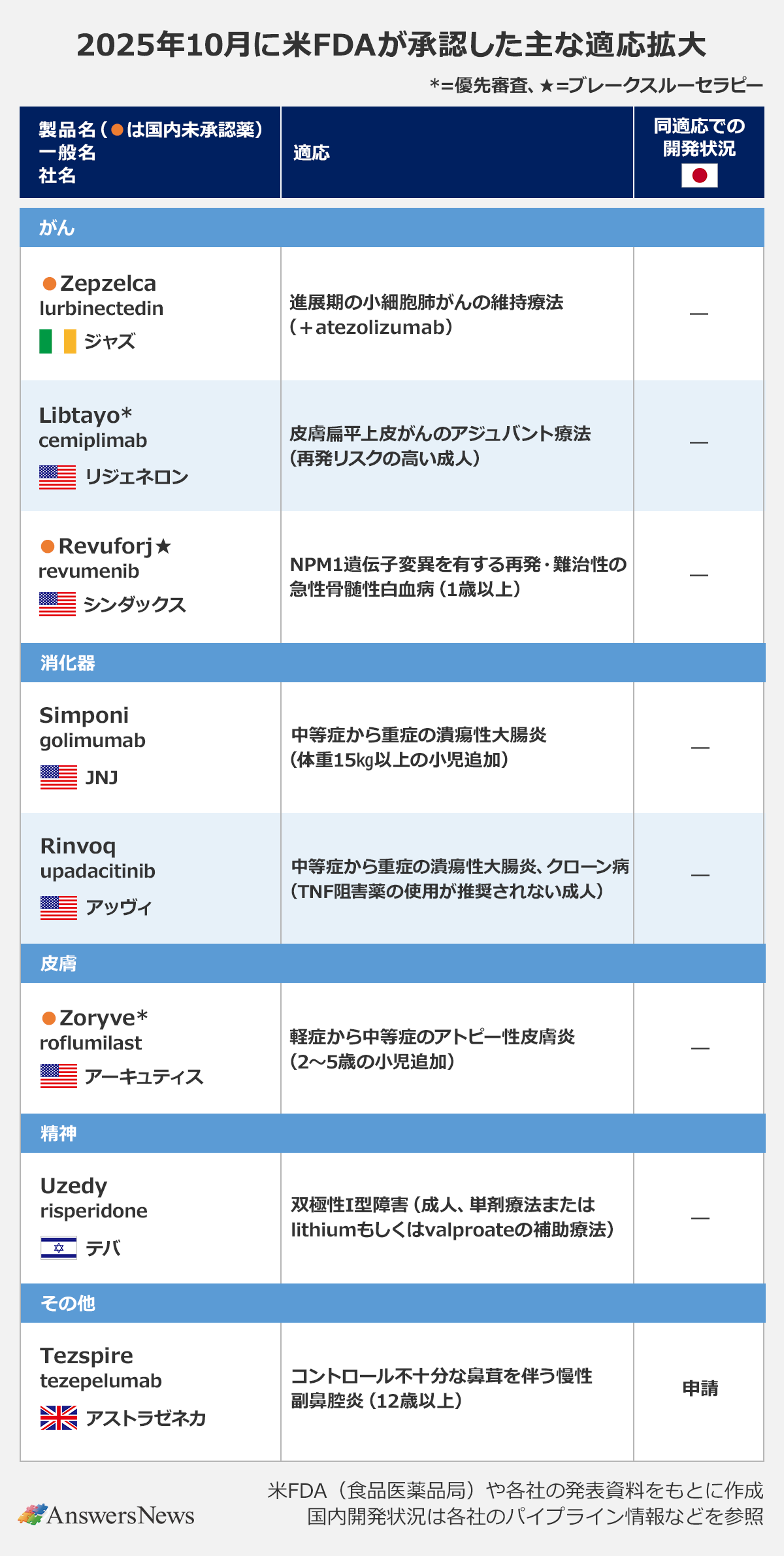
がん
Zepzelca|アイルランド・ジャズファーマシューティカルズ
「Zepzelca」(lurbinectedin)は、進展期の小細胞肺がんの維持療法を対象に抗PD-L1抗体atezolizumabとの併用療法が承認されました。対象は、atezolizumabとcarboplatin、etoposideによる1次治療後に進行しなかった患者。臨床試験では、atezolizumab単独の維持療法と比べて病勢進行・死亡リスクを有意に減少しました。同薬は腫瘍原性転写経路を選択的に阻害する作用を持つ海洋生物由来化合物ET-736のアナログで、スペインのファーママーが開発。欧州では今年5月に同社が維持療法を対象に新薬申請を行いました。日本では今年4月、独メルクがファーママーからライセンスを取得しました。
Libtayo|米リジェネロン・ファーマシューティカルズ
抗PD-1抗体「Libtayo」(cemiplimab)は、手術・放射線療法後の再発リスクの高い皮膚扁平上皮がん(CSCC)に対するアジュバント療法として新たに承認を取得。P3試験では、プラセボと比べて再発または死亡のリスクを68%低減しました。同薬は米国で18年、欧州で19年に転移性・局所進行性CSCC治療薬として承認。欧州でも近くアジュバント療法への適応拡大が承認される見通しです。日本では子宮頸がんと非小細胞肺がんの適応で承認されています。
Revuforj|米シンダックス・ファーマシューティカルズ
メニン阻害薬「Revuforj」(revumenib)は、NPM1遺伝子変異を有する再発・難治性の急性骨髄性白血病に適応拡大。満足な代替治療法のない1歳以上の患者が対象です。承認の根拠となったP2試験の奏効率は23%で、奏効持続期間の中央値は4.5カ月でした。同薬は24年11月、KMT2A転座を有する再発・難治性の急性白血病治療薬として承認されました。
消化器
Simponi|米ジョンソン・エンド・ジョンソン
抗TNFα抗体「Simponi」(golimumab)は、中等症から重症の潰瘍性大腸炎の適応で体重15kg以上の小児に対象を拡大しました。成人に対しては13年に承認されています。
Rinvoq|米アッヴィ
JAK阻害薬「Rinvoq」(upadacitinib)は、中等症から重症の潰瘍性大腸炎とクローン病の適応で、臨床的にTNF阻害薬の使用が推奨されず、1つ以上の全身療法を受けた成人患者への使用が認められました。従来は1種類以上のTNF阻害薬で効果不十分または不耐容の患者が対象でした。
皮膚
Zoryve|米アーキュティス
PDE4阻害薬「Zoryve」(roflumilast)は、軽度から中等度のアトピー性皮膚炎の適応で2~5歳の小児を対象とする0.05%クリーム製剤が承認されました。1日1回塗布します。従来、アトピー性皮膚炎の適応では、6歳以上の患者向けに0.15%クリームが承認されていました。日本では24年に佐藤製薬が皮膚疾患を対象にライセンスを取得しています。
その他
Tezspire|英アストラゼネカ
抗TSLP抗体「Tezspire」(tezepelumab)は、12歳以上のコントロール不十分な鼻茸を伴う慢性副鼻腔炎に適応拡大。臨床試験では、プラセボと比べて統計的に有意かつ臨床的に意義のある重症度の軽減を示し、全身性コルチコステロイドの使用が大幅に減少しました。欧州でも近く承認される見通しで、日本や中国でも申請中です。
【バイオシミラー】セルトリオンのaflibercept

Eydenzelt|韓国セルトリオン
「Eydenzelt」は、米国で6剤目となる眼科用VEGF阻害薬「Eylea」(aflibercept)のバイオシミラー。欧州でも今年2月に承認されています。












